
杀菌剂在农业生产中扮演着至关重要的角色,对防治植物病害和提高作物产量具有显著作用。目前市场上现有的杀菌剂类型中,三唑类杀菌剂是全球范围内品种最为丰富的杀菌剂类别之一,被广泛应用于农业生产实践中。
三唑类杀菌剂以其独特的内吸功能和保护、治疗作用,在防治由子囊菌、担子菌等真菌引起的病害方面展现出卓越效果,被广泛用于白粉病、锈病等病害的防治。近10年来,三唑类杀菌剂的新品种开发进展缓慢,并且随着长期大量且不合理的使用,多种农业真菌病如曲霉病、赤霉病、白粉病、炭疽病、叶斑病和黑斑病等已对传统三唑类杀菌剂产生了严重的抗药性。面对日益严重的病害抗药性问题,亟需加强新型三唑类杀菌剂品种的研发,以满足农业生产对高效、安全农药的迫切需求。
fluoxytioconazole(开发代号x12499481、xr-481和xde-481)是由美国维亚梅特制药公司发现的含吡啶片段的三唑类杀菌剂,后由科迪华公司进行商业化开发。fluoxytioconazole的化学结构独特(见图1),杀菌活性良好,目前给出的可能作用机制是化合物三唑环上sp2杂化的原子具有孤对电子,可阻碍铁啉氧络合物的形成,进而抑制麦角甾醇的合成。麦角甾醇是真菌细胞膜的重要组成成分,抑制麦角甾醇的合成可以破坏真菌生物体正常的细胞结构和功能。
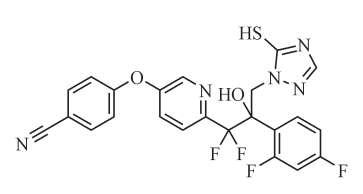
图1 fluoxytioconazole结构式
本实验以4-氟苯腈为原料,经过7步反应制得目标化合物fluoxytioconazole。在温室条件下测试了目标化合物对农业真菌病大豆锈病、小麦白粉病、黄瓜霜霉病和大豆灰霉病的防效。同时,探究了药物分子与靶标受体蛋白之间的结合模式,将fluoxytioconazole与真菌甾醇-14α-去甲基化酶(cyp51)进行了分子对接,并以此判断fluoxytioconazole对靶蛋白是否有较强的亲和力,旨在为后续fluoxytioconazole及其类似物在农业真菌防治领域提供新的应用方向、研发方向及理论支撑。
1 材料和方法
1.1 实验材料
4-氟苯腈,纯度97%,安徽泽升科技有限公司;碳酸铯(cs2co3),分析纯,上海迈瑞尔生化科技有限公司;乙腈(mecn),分析纯,天津市大茂化学试剂厂;三乙胺(tea)、异丙醇(i-proh)、n-甲基吡咯烷酮(nmp)、n,n-二甲基甲酰胺(dmf),分析纯,天津市富宇精细化工有限公司;二氯乙烷(dce)、二氯甲烷(dcm),分析纯,永华化学股份有限公司;2-溴-5-羟基吡啶,纯度97%,天津希恩思生化科技有限公司;碳酸钾(k2co3)、碳酸氢钠(nahco3),分析纯,天津市恒兴化学试剂制造有限公司;2-溴-2,2-二氟乙酸乙酯,纯度98%,上海皓鸿生物医药科技有限公司;三甲基碘化亚砜,纯度98%,上海毕得医药科技股份有限公司;1h-1,2,4-三唑,纯度97%,天津希恩思生化科技有限公司;1,2-乙二硫醇,纯度98%,上海皓鸿生物医药科技有限公司;氯化亚砜(socl2),化学纯,上海麦克林生化科技股份有限公司;甲苯、甲基叔丁基醚(mtbe),分析纯,辽宁泉瑞试剂有限公司;1-溴-2,4-二氟苯,纯度97%,上海毕得医药科技股份有限公司;n,n-二异丙基乙胺(dipea),分析纯,上海阿拉丁生化科技股份有限公司;n-溴代丁二酰亚胺(nbs),纯度97%,陕西瑞科新材料股份有限公司;偶氮二异丁腈(aibn),纯度98%,陕西瑞科新材料股份有限公司。
1.2 分析测试仪器
avance iii 600 mhz核磁共振波谱仪,瑞士布鲁克公司;accurate-mass q-tof lc-ms液质联用仪,美国安捷伦公司;cheetah中压快速纯化制备色谱,天津博纳艾杰尔科技有限公司;n-1300型旋转蒸发仪,东京理化器械株式会社;mp450全自动熔点仪,济南海能仪器股份有限公司。
1.3 化合物的合成
通过文献调研,本实验采用了如下路线合成fluoxytioconazole,见图2。
图2 fluoxytioconazole的合成路线
1.3.1 中间体4-((6-溴吡啶-3-基)氧基)苯甲腈(ⅱ)的合成
向1,000 ml单口烧瓶中加入2-溴-5-羟基吡啶29.83 g(171.44 mmol)、4-氟苯腈25.05 g(206.83 mmol)、碳酸钾47.68 g(344.99 mmol)和n,n-二甲基甲酰胺(250 ml),升温至90℃,反应4 h,薄层色谱法(tlc)监测至反应完全。将反应液冷却至20℃,加入水(250 ml),搅拌1 h,过滤,用水(100 ml)漂洗滤饼,将滤饼加入到95%乙醇(65 ml)中并加热至75℃,待其完全溶解后,将溶液自然冷却至20℃,搅拌2 h,将悬浮液过滤,用95%乙醇(5 ml)冲洗滤饼,真空干燥,得到白色固体43.34 g,即中间体ⅱ,收率为76.17%,熔点116.9~118.5℃。1h nmr(600 mhz,dmso-d6)δ:8.34(d,j=3.0 hz,1h),7.89(d,j=8.8 hz,2h),7.74(d,j=8.6 hz,1h),7.62(dd,j=8.7,3.1 hz,1h),7.25~7.21(m,2h)。esi-ms(m/z):[m h] 测试值275.94。
1.3.2 中间体2-(5-(4-氰基苯氧基)吡啶-2-基)-2,2-二氟乙酸乙酯(ⅲ)的合成
将7.84 g(28.50 mmol)中间体ⅱ加入至500 ml单口烧瓶中,加入n,n-二甲基甲酰胺(140 ml),在氮气保护下加入2-溴-2,2-二氟乙酸乙酯8.98 g(44.24 mmol)和铜粉9.60 g(151.00 mmol)。在氮气氛围下升温至60℃,反应18 h,tlc监测至反应完全。将反应液冷却至20℃,加入mtbe(280 ml),搅拌10 min后经硅藻土过滤。用mtbe(140 ml×2)冲洗滤饼。将滤液依次用饱和nh4cl溶液(200 ml)、水(140 ml×2)和饱和nacl溶液(140 ml×2)洗涤,有机相经无水na2so4干燥、过滤、减压浓缩、柱层析纯化,得到白色固体6.67 g,即中间体ⅲ,收率为73.54%,熔点45.8~47.2℃。1h nmr(600 mhz,dmso-d6)δ:8.58(d,j=2.7 hz,1h),7.93(dd,j=8.6,4.4 hz,3h),7.78(dd,j=8.7,2.8 hz,1h),7.34~7.31(m,2h),4.35(q,j=7.1 hz,2h),1.25(t,j=7.1 hz,3h)。esi-ms(m/z):[m h] 测试值319.36。
1.3.3 中间体4-((6-(2-(2,4-二氟苯基)-1,1-二氟-2-氧代乙基)吡啶-3-基)氧基)苯甲腈(ⅳ)的合成
将镁屑1.30 g(53.49 mmol)加入到250 ml单口烧瓶中,加入四氢呋喃(55 ml),在氮气氛围下升温至35℃,用注射器向瓶中滴加1-溴-2,4-二氟苯7.31 g(37.88 mmol),在35℃下搅拌30 min,将反应液冷却至0~5℃,加入中间体ⅲ 8.60 g(27.02 mmol),在0~5℃下搅拌1 h,tlc监测至反应完全。向反应液中加入饱和nh4cl溶液(50 ml),在20℃下搅拌18 h。通过etoac(45 ml)萃取、nahco3溶液(45 ml)洗涤、无水na2so4干燥和过滤,得到浅褐色固体。将该固体溶解于etoac(20 ml)和正庚烷(45 ml)中,并在室温下搅拌18 h形成悬浮液。过滤并干燥后,得到白色固体(中间体ⅳ)10.65 g,滤液经mtbe(20 ml)和正庚烷(20 ml)重结晶,干燥后得到浅棕色固体(中间体ⅳ)8.68 g,收率为83.16%,熔点84.7~85.4℃。1h nmr(600 mhz,cdcl3)δ:8.37(s,1h),8.08(q,j=8.1 hz,1h),7.87(d,j=8.6 hz,1h),7.70(d,j=8.5 hz,2h),7.54(d,j=11.0 hz,1h),7.11(d,j=8.5 hz,2h),7.01(t,j=8.2 hz,1h),6.84(t,j=10.6 hz,1h)。esims(m/z):[m h] 测试值387.22。
1.3.4 中间体4-((6-((2-(2,4-二氟苯基)环氧乙烷-2-基)二氟甲基)吡啶-3-基)氧基)苯甲腈(ⅴ)的合成
在冰浴(0~5℃)下,将三甲基碘化亚砜1.42 g(6.45 mmol)、nmp(65 ml)、碳酸钾1.79 g(12.95 mmol)依次加入到250 ml单口烧瓶中,在20℃下搅拌反应2 h以得到白色悬浮液,加入中间体iv 2.00 g(5.18 mmol),并在氮气下升温至35℃搅拌反应18 h,tlc监测至反应完全,所得反应液直接用于下一步反应。
1.3.5 中间体4-((6-(2-(2,4-二氟苯基)-1,1-二氟-2-羟基-3-(1h-1,2,4-三唑-1-基)丙基)吡啶-3-基)氧基)苯甲腈(ⅵ)的合成
向1.3.4所得反应液中加入1h-1,2,4-三唑2.72 g(39.38 mmol),升温至60℃,反应18 h。再升温至80℃反应1 h,tlc监测至反应完全,将反应液冷却至20℃并倒入至冰水(120 ml)中,在0~5℃下搅拌1 h,将所得悬浮液过滤,将固体溶解于dcm(120 ml)中,用饱和nacl溶液(2×30 ml)洗涤,将有机层减压浓缩,经柱层析纯化得到淡黄色固体1.68 g,即中间体ⅵ,收率为69.22%,熔点42.4~44.1℃。1h nmr(600 mhz,dmso-d6)δ:8.46(d,j=2.7 hz,1h),8.36(s,1h),7.93~7.91(m,2h),7.71(s,1h),7.69(dd,j=8.6,2.8 hz,1h),7.51(d,j=8.6 hz,1h),7.27~7.23(m,1h),7.22~7.19(m,2h),7.12(ddd,j=12.0,9.1,2.6 hz,1h),7.04(s,1h),6.88(td,j=8.5,2.6 hz,1h),5.35(d,j=14.7 hz,1h),4.83(d,j=14.7 hz,1h)。esi-ms(m/z):[m h] 测试值470.37。
1.3.6 中间体4-((6-(3-(5-溴-1h-1,2,4-三唑-1-基)-2-(2,4-二氟苯基)-1,1-二氟-2-羟基丙基)吡啶-3-基)氧基)苯甲腈(ⅶ)的合成
向25 ml单口烧瓶中加入中间体vi 0.50 g(1.07 mmol)、nbs 0.28 g(1.57 mmol)和aibn 0.04 g(0.24 mmol),加入乙腈(2 ml),升温至75℃,反应6 h,tlc监测至反应完全,减压浓缩,经柱层析纯化得到淡黄色固体0.52 g,即中间体ⅶ,收率为89.04%,熔点170.6~173.3℃。1h nmr(600 mhz,dmso-d6)δ:8.51(d,j=2.8 hz,1h),7.95~7.92(m,2h),7.84(s,1h),7.73(dd,j=8.7,2.8 hz,1h),7.61(d,j=8.6 hz,1h),7.34(td,j=8.9,6.6 hz,1h),7.25~7.21(m,2h),7.18(ddd,j=12.0,9.1,2.7 hz,1h),6.99(td,j=8.4,2.6 hz,1h),6.89(s,1h),5.20(d,j=14.6 hz,1h),4.91(d,j=14.6 hz,1h)。esi-ms(m/z):[m na] 测试值570.71。
1.3.7 fluoxytioconazole的合成
向25 ml单口烧瓶中加入中间体ⅶ1.00 g(1.82 mmo1)、1,2-乙二硫醇0.31 g(3.29 mmol)、cuso4·5h2o 0.46 g(1.84 mmol)、cs2co3 1.19 g(3.65 mmol)和nmp(5 ml),升温至100℃反应4 h,tlc监测至反应完全。将反应液冷却至20℃并用水(20 ml)稀释,用etoac(20 ml×2)萃取,分出有机相,减压浓缩,经柱层析纯化得到浅棕色固体0.69 g,即fluoxytioconazole,收率为75.44%,熔点148.7~150.5℃。1h nmr(600 mhz,dmso-d6)δ:13.58(s,1h),8.46(d,j=2.7 hz,1h),8.14(s,1h),7.95~7.88(m,2h),7.70(dd,j=8.6,2.8 hz,1h),7.63(d,j=8.7 hz,1h),7.37(td,j=8.9,6.8 hz,1h),7.24~7.19(m,2h),7.16(td,j=9.2,4.6 hz,1h),6.95(td,j=8.4,2.6 hz,1h),6.48(s,1h),5.07(q,j=14.6 hz,2h)。esi-ms(m/z):[m h] 测试值502.45。
1.4 生物活性测试
采用活体盆栽法。测试靶标为黄瓜霜霉病、小麦白粉病、大豆灰霉病和大豆锈病,对照药剂分别为代森锰锌、烯肟菌胺、啶菌噁唑和嘧菌酯。fluoxytioconazole及对照药剂分别用适宜溶剂(如丙酮/甲醇、dmf,溶剂量≤喷液量0.05倍)溶解,再用含0.1%吐温80的自来水稀释成待测液,另设清水为空白对照。将待测液喷施于温室内的标准盆栽病害植物上,24 h后接种病害。根据病害需求,控温保湿植物置于人工气候室培养,非保湿植物直接温室培养。对照发病7 d后,评估防病效果。
1.5 药物分子与受体蛋白的相互作用模式研究
1.5.1 靶标蛋白
三唑类杀菌剂属于甾醇脱甲基抑制剂(demethylase inhibitors,dmis)。dmis的靶标蛋白是病原真菌的甾醇-14α-去甲基化酶(cyp51),见图3,其作用机理主要是通过抑制该酶的活性阻断真菌细胞膜主要成分麦角甾醇的合成,同时造成大量有害中间产物的积累,破坏细胞膜的结构与功能。由于麦角甾醇在真菌细胞中的重要性以及特异性,其生物合成途径中的关键酶甾醇-14α-去甲基化酶(cyp51)是抗真菌药物的理想靶标。
图3 甾醇-14α-去甲基化酶的蛋白结构
1.5.2 分子对接
为探索fluoxytioconazole受体蛋白的相互作用模式,选取甾醇-14α-去甲基化酶(cyp51)作为目标蛋白,将其与目标化合物进行分子对接。从pdb数据库中获取甾醇-14α-去甲基化酶(pdb编号:4uyl)将其作为受体蛋白,使用pymol软件对受体蛋白结构进行预处理,去除其中的小分子配体和水分子,并计算蛋白质结构的电荷数。绘制fluoxytioconazole的三维结构及结合域中心,设置对接中心,使用autodock软件将目标化合物与受体蛋白进行半柔性对接。
2 结果与讨论
2.1 杀菌活性结果
杀菌活性测试结果见表1。由表中数据可知,在6.25 mg/l质量浓度下,fluoxytioconazole对小麦白粉病和大豆锈病表现出100%的防效;在3.125 mg/l质量浓度下,对小麦白粉病和大豆锈病仍有高达93%和98%的防效,表现出良好的杀菌活性;在所供测试质量浓度范围内,fluoxytioconazole未对黄瓜霜霉病及大豆灰霉病表现出明显的杀菌活性。
表1 fluoxytioconazole的杀菌活性
2.2 分子对接结果
化合物fluoxytioconazole与受体对接结果见图4。leu b:471、his b:359、ile b:363、ala b:360、gly b:474、tyr b:470、ser b:431号残基与fluoxytioconazole形成范德华力作用;化合物羟基上的氧原子与ala b:430号残基形成氢键;leu b:353号残基与苯环形成疏水作用。值得注意的是,gln b:467号残基与目标化合物吡啶环上相连的2个f原子形成卤键作用,这可能是fluoxytioconazole表现出较好抗菌活性的原因之一。
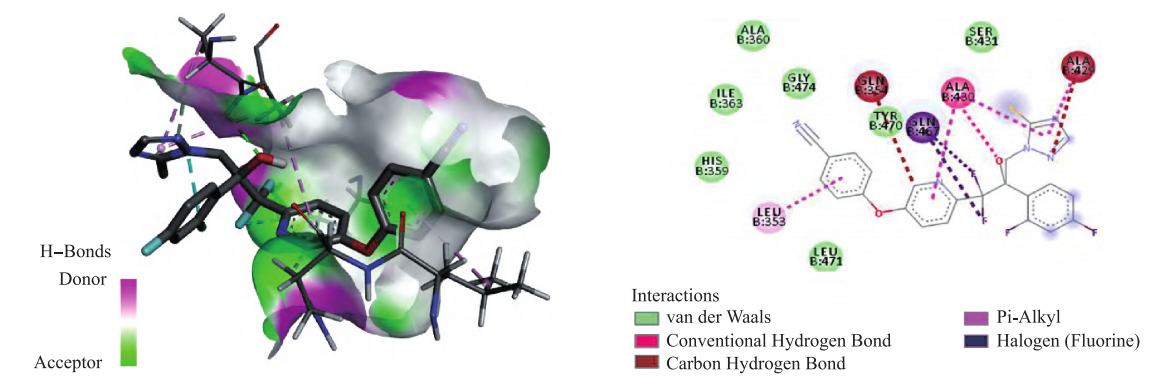
图4 fluoxytioconazole与受体对接3d模式与2d模式示意图
3 结论
以4-氟苯腈为原料,经过7步反应制得目标化合物fluoxytioconazole,其结构经1h nmr、lc-ms确证,该路线反应条件温和、原料廉价易得。生物活性测试结果表明:在测试质量浓度为3.125 mg/l时,fluoxytioconazole对小麦白粉病具有93%的防效,对大豆锈病有98%的防效,对小麦白粉病和大豆锈病的杀菌活性优异,但在所供测试质量浓度范围内,未对黄瓜霜霉病及大豆灰霉病表现出明显的杀菌活性。分子对接结果表明:fluoxytioconazole与受体蛋白之间存在多种相互作用,具有较高的亲和性。然而,单个酶的功能因物种而异,cyp51蛋白酶在不同的物种中作用效果不同,这可能是fluoxytioconazole抗菌表现差异化的原因。
本实验合成了新杀菌剂fluoxytioconazole,并对其进行了杀菌活性测试和分子对接,可为后续fluoxytioconazole及其类似物在农业真菌防治领域的研究提供参考。
(1)本网旨在传播信息,促进交流,多方面了解农药发展动态,但不构成任何投资建议。
(2)所有文章仅代表作者观点,不代表本网立场。
(3)“信息来源:江苏省农药协会 农药资讯网”为原创文章,转载时请注明来源和作者。
(4)本网转载文章及图片的尊龙游戏旗舰厅官网的版权属于原作者,若有侵权,请联系删除。